Нитробензол
| Нитробензол | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование |
Нитробензол | ||
| Традиционные названия | Нитробензол; мирабановое масло, мирабановая эссенция | ||
| Хим. формула | C6H5NO2 | ||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 123,06 г/моль | ||
| Плотность | 1,199 г/см³ | ||
| Энергия ионизации | 9,92 ± 0,01 эВ[1] и 9,86 эВ[2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 5,85 °C | ||
| • кипения | 210,9 °C | ||
| • вспышки | 88 °C | ||
| • самовоспламенения | 482 °C | ||
| Пределы взрываемости | 1,8 ± 0,1 об.%[1] | ||
| Уд. теплоёмк. | 1510 Дж/(кг·К) | ||
| Давление пара | 0,3 ± 0,1 мм рт.ст.[1] | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 0,19 г/100 мл (20 °C) | ||
| Оптические свойства | |||
| Показатель преломления | 1,5562 | ||
| Структура | |||
| Дипольный момент | 4,22 Д | ||
| Классификация | |||
| Рег. номер CAS | 98-95-3 | ||
| PubChem | 7416 | ||
| Рег. номер EINECS | 202-716-0 | ||
| SMILES | |||
| InChI | |||
| RTECS | QJ0525000 | ||
| ChEBI | 27798 | ||
| ChemSpider | 7138 | ||
| Безопасность | |||
| Предельная концентрация | 1 мг/м3 | ||
| ЛД50 | 120-140 мг/кг | ||
| Токсичность | Класс опасности 2 | ||
| Фразы риска (R) | R23/24/25, R40, R48/23/24, R51/53, R62 | ||
| Фразы безопасности (S) | (S1/2), S28, S36/37, S45, S61 | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Нитробензо́л — ароматическое нитросоединение, простейший представитель класса нитробензолов. При комнатной температуре является бледно-желтой маслянистой жидкостью с характерным запахом горького миндаля.
Физические свойства
При замерзании нитробензол образует зеленовато-желтые кристаллы. Не растворяется в воде (0,19 % по массе при 297 K, 0,8 % при 350 K). Растворяется в концентрированных кислотах (при разведении таких растворов водой осаждается)[3]. Неограниченно смешивается с диэтиловым эфиром, бензолом, некоторыми другими органическими растворителями. Перегоняется с водяным паром. Показатель преломления (для D-линии натрия (589 нм), при 297K) 1,5562. Дипольный момент газообразных молекул (в дебаях) 4,22 D. Удельная теплоёмкость 1,51 Дж/(г·К)[4].
Получение
Основной способ получения нитробензола (как и других нитроаренов) — нитрование в условиях электрофильного замещения бензола (соответственно, аренов)[3]. Электрофильной частицей является ион нитрония NO2+[5][6]. В промышленности нитробензол получают непрерывным нитрованием бензола смесью концентрированных H2SO4 и HNO3 с выходом 96—99 %.
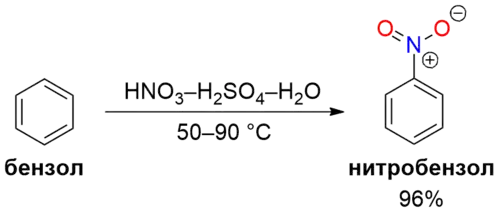
В лабораторных условиях нитробензол получают нитрованием бензола смесью H2SO4 (1,84 г/см3) и HNO3 (1,4 г/см3) в соотношении 1:1 при 40—60 °C (45 мин). Выход целевого продукта достигает 80 %.
Принципиально возможна (но не применяется в силу низкого выхода) реакция нитрования бензола концентрированной азотной кислотой[5]. Несколько реже (как и для получения других нитроаренов) в лабораториях используют замещение, модификацию или элиминирование заместителей, уже имеющихся при бензольном кольце[3].
Например, возможно получать нитробензол окислением анилина перокситрифторуксусной кислотой (или другими окислителями; чем менее кислая среда — тем больше доля азоксибензола в продуктах)[6].
Химические свойства
Электрофильное замещение
В связи с сильным электроноакцепторным действием нитрогруппы реакции электрофильного замещения идут в мета-положение, и скорость реакции ниже чем у бензола.
- При нитровании образуется смесь изомеров: 93% м-динитробензола, 6% о-динитробензола и 1% п-динитробензола.[7]

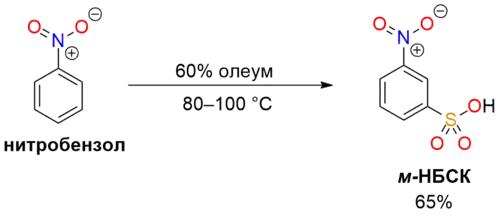
- При сульфировании 60% олеумом получается м-нитробензосульфокислота (м-НБСК).[8]
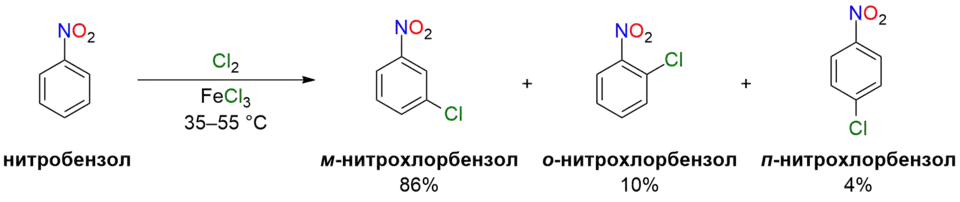
- При хлорировании нитробензола в присутствии катализатора образуется 3-нитрохлорбензол.[9]
- При бромировании в присутствии железа образуется м-бромнитробензол с хорошим выходом.[10]

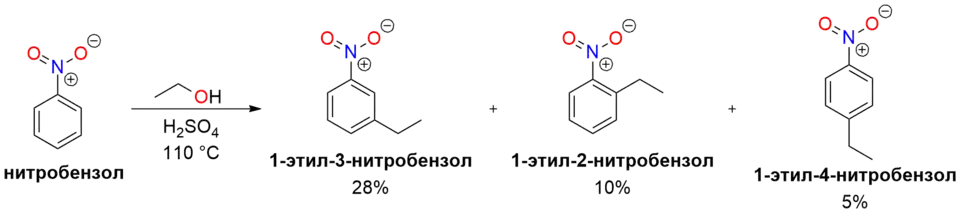
- Нитробензол не вступает в реакцию Фриделя-Крафтса.[11] Были найдены условия, в которых нитробензол алкилируется в смеси этанола и серной кислоты, однако реакция обладает низкими выходами и имеет лишь академическую ценность.[12]
Нуклеофильное замещение
- При нагревании нитробензола с твердым гидроксидом калия образуется о-нитрофенол с низким выходом.[13] Выход о-нитробензола не может быть выше 50% от теоретического, так как данная реакция представляет собой диспропорционирование нитробензола.
.png)
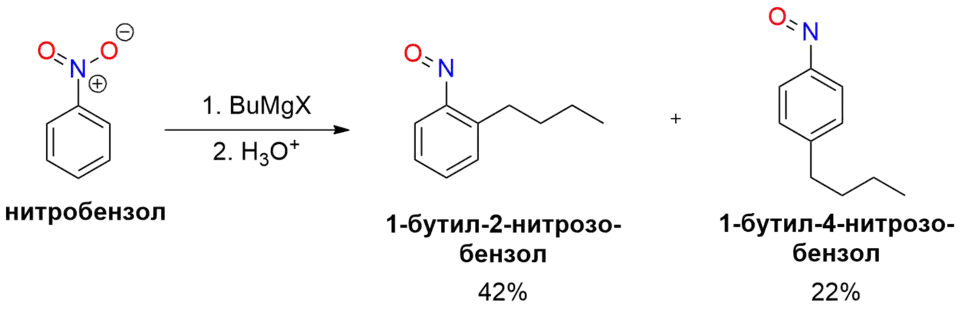
- Реакция нитробензола с магнийорганическими соединениями приводит к образованию смеси орто- и пара-алкилнитрозобензолов в соотношении ~2:1.[3][14]
Восстановление
Бо́льшая часть (~95%) производимого нитробензола используется в качестве сырья для синтеза анилина.[9]
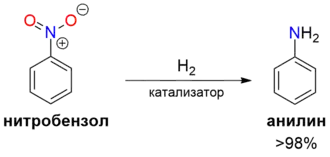
Реакция восстановления нитробензола в анилин под действием сульфида аммония была открыта Н. Н. Зинином ещё в 1842 году.[15] Однако в настоящее время для производства анилина из нитробензола применяется гидрирование в присутствии катализаторов (Cu/SiO2 или Pd/Al2O3). Выход анилина при каталитическом гидрировании составляет >98 %.
К продуктами частичного восстановления нитробензола можно отнести следующие вещества:
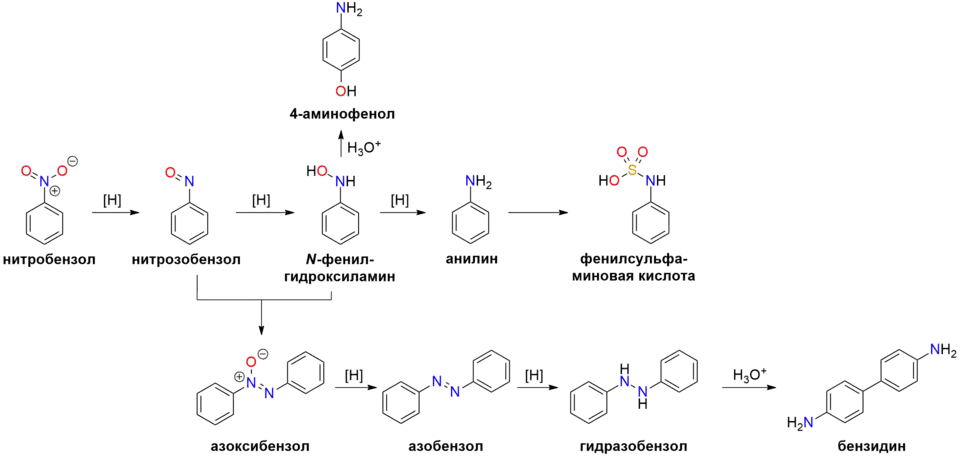
| # | Восстановитель | Продукт | Комментарий |
|---|---|---|---|
| 1 | Zn – NH4Cl(р-р)[16] | N-фенилгидроксиламин | Под действием кислот перегруппировывается в 4-аминофенол[17] |
| 2 | Na3AsO3[18] | Азоксибензол | |
| 3 | Zn – NaOH(р-р)[19] | Азобензол | |
| Гидразобензол | Под действием кислот гидразобензол перегруппировывается в бензидин[20] | ||
| 4 | LiAlH4[21] | Азобензол | |
| 5 | Na2S2O3 – Na3PO4 | Фенилсульфаминовая кислота |
Применение
Исходное сырьё в производстве анилина, ароматических азотсодержащих соединений (бензидин, хинолин, азобензол), растворитель эфиров целлюлозы[11], компонент полировальных составов для металлов. Применяется как растворитель и мягкий окислитель.
Производные нитробензола используются в качестве взрывчатых веществ и как компоненты ракетных топлив. В парфюмерии — в качестве душистых или фиксирующих запах веществ, в том числе — искусственных мускусов. Сам нитробензол ранее выпускали под названием «горько-миндального» или «мирабанового» масла. Некоторые производные нитробензола используются в составе лаков и красок. Некоторые применяются в медицине[3][5].
Биологическая роль и токсичность
Нитробензол токсичен: относится ко второму классу опасности и в больших концентрациях может вызывать гемолиз. Впитывается через кожу, оказывает сильное действие на ЦНС, нарушает обмен веществ, вызывает заболевания печени, окисляет гемоглобин в метгемоглобин.
ПДК в рабочей зоне — 1 мг/м³, ЛД50 — 120 мг/кг на крысах.
См. также
- 4-Нитрохлорбензол
- 2-Нитрохлорбензол
- Метгемоглобинообразователи
- 3-Нитрохлорбензол
- Высокотоксичные вещества
- Нитросоединения
Примечания
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0450.html
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ 1 2 3 4 5 Шабаров Ю. С. «Органическая химия», М.:Химия, 2002, стр. 848. ISBN 5-7245-1218-1, стр. 715—725
- ↑ Волков А. И. Жарский И. М. «Большой химический справочник». Мн.:Современная школа, 2005, 608 с. ISBN 985-6751-04-7 стр. 257, 267
- ↑ 1 2 3 Горленко В. А. и др. «Органическая химия», М.:Мастерство, 2003, стр. 624. ISBN 5-294-00176-4, стр. 397—403
- ↑ 1 2 Бартон Д, Оллис Д.(ред.) «Общая органическая химия» в 12 т., М.:Химия, 1982. Т.3, стр. 403—410
- ↑ Электрофильное замещение в ароматическом ряду. 3.1. www.chem.msu.su. Дата обращения: 4 июля 2025. Архивировано 4 июля 2025 года.
- ↑ Электрофильное замещение в ароматическом ряду. 3.6. www.chem.msu.su. Дата обращения: 7 июля 2025.
- ↑ 1 2 Gerald Booth. Nitro Compounds, Aromatic (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. — John Wiley & Sons, Ltd, 2000. — ISBN 978-3-527-30673-2. — doi:10.1002/14356007.a17_411. Архивировано 25 февраля 2025 года.
- ↑ Гельман Х. (ред.) Казанский Б. А. (ред.) «Синтезы органических препаратов», М.: Гос. Изд-во иностранной литературы, 1949. Сб. 1, стр. 130—134. Сб. 2, стр. 12-15. Сб. 3, стр. 7-8, 354—356
- ↑ 1 2 Кнунянц И. Л. (глав.ред.) «Химическая энциклопедия» в пяти томах. М.:Советская энциклопедия, 1988. Т.3, стр. 267—268
- ↑ Yusheng Shen, Hongxia Liu, Yiqiu Chen. The first Friedel-Crafts reaction of nitrobenzene // The Journal of Organic Chemistry. — 1990-06-01. — Т. 55, вып. 12. — С. 3961–3962. — ISSN 0022-3263. — doi:10.1021/jo00299a051.
- ↑ A. Wohl. Ueberführung von Nitrobenzol in o ‐Nitrophenol durch Kalihydrat (англ.) // Berichte der deutschen chemischen Gesellschaft. — 1899-10. — Vol. 32, iss. 3. — P. 3486–3488. — ISSN 0365-9496. — doi:10.1002/cber.189903203122. Архивировано 1 июня 2024 года.
- ↑ Giuseppe Bartoli. Conjugate addition of alkyl Grignard reagents to mononitroarenes // Accounts of Chemical Research. — 1984-03-01. — Т. 17, вып. 3. — С. 109–115. — ISSN 0001-4842. — doi:10.1021/ar00099a005.
- ↑ Otto Linné Erdmann. Journal für praktische Chemie. — J. A. Barth, 1842. — 546 с.
- ↑ Organic Syntheses Procedure (англ.). orgsyn.org. Дата обращения: 17 июля 2025. Архивировано 17 июня 2025 года.
- ↑ Stephen C. Mitchell, Rosemary H. Waring. Aminophenols (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. — John Wiley & Sons, Ltd, 2000. — ISBN 978-3-527-30673-2. — doi:10.1002/14356007.a02_099.
- ↑ Organic Syntheses Procedure (англ.). orgsyn.org. Дата обращения: 17 июля 2025. Архивировано 1 декабря 2024 года.
- ↑ Organic Syntheses Procedure (англ.). www.orgsyn.org. Дата обращения: 17 июля 2025. Архивировано 20 января 2025 года.
- ↑ Нитро- и диазосоединения. 2.3. www.chem.msu.su. Дата обращения: 17 июля 2025. Архивировано 23 марта 2025 года.
- ↑ Robert F. Nystrom, Weldon G. Brown. Reduction of Organic Compounds by Lithium Aluminum Hydride. III. Halides, Quinones, Miscellaneous Nitrogen Compounds1 // Journal of the American Chemical Society. — 1948-11-01. — Т. 70, вып. 11. — С. 3738–3740. — ISSN 0002-7863. — doi:10.1021/ja01191a057.
Литература
- Кнунянц И. Л. и др. т.3 Мед-Пол // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1992. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8.